Einige grundlegende Fachbegriffe kurz erklärt.
Referenzelektrode » elektrochemische Doppelschicht » Elektrolyt » Potentiostat » Keimbildung » Strom » Aktivierungsenergie » Tafel » Nernst »
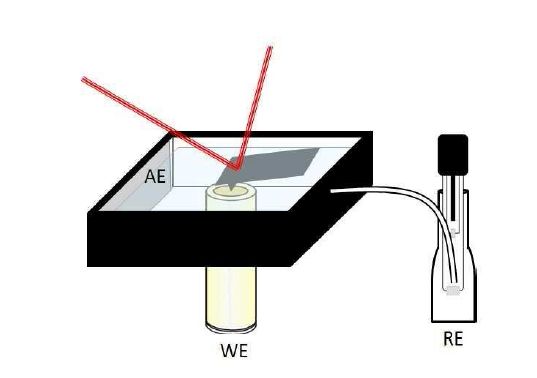
3-Elektrodenaufbau
Damit das Potential der Arbeitselektrode (AE) korrekt gemessen wird, sollte eine Referenzelektrode stromlos verbunden sein. Der Strom wird über eine Gegenelektrode (Hilfselektrode) geleitet.
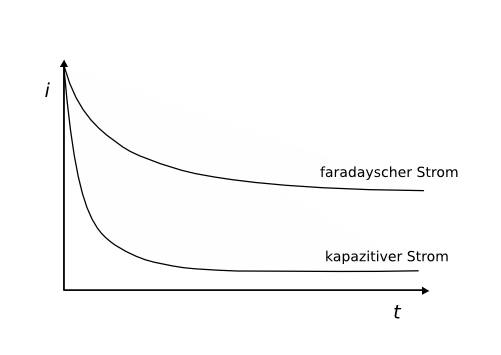
Kapazitiver Strom
Entsteht durch Aufladung der elektrochemischen Doppelschicht. Unerwünschter Nebeneffekt, wenn ein Stoffumsatz gemessen werden soll. Z.B. bei der Analyse von Metallen oder sonstigen Stoffumsätzen mit Faradayschen Strömen. Deswegen wird oft ein Moment gewartet bis der Strom gemessen wird, da der kapazitive Strom schneller abklingt als der faradaysche Strom.
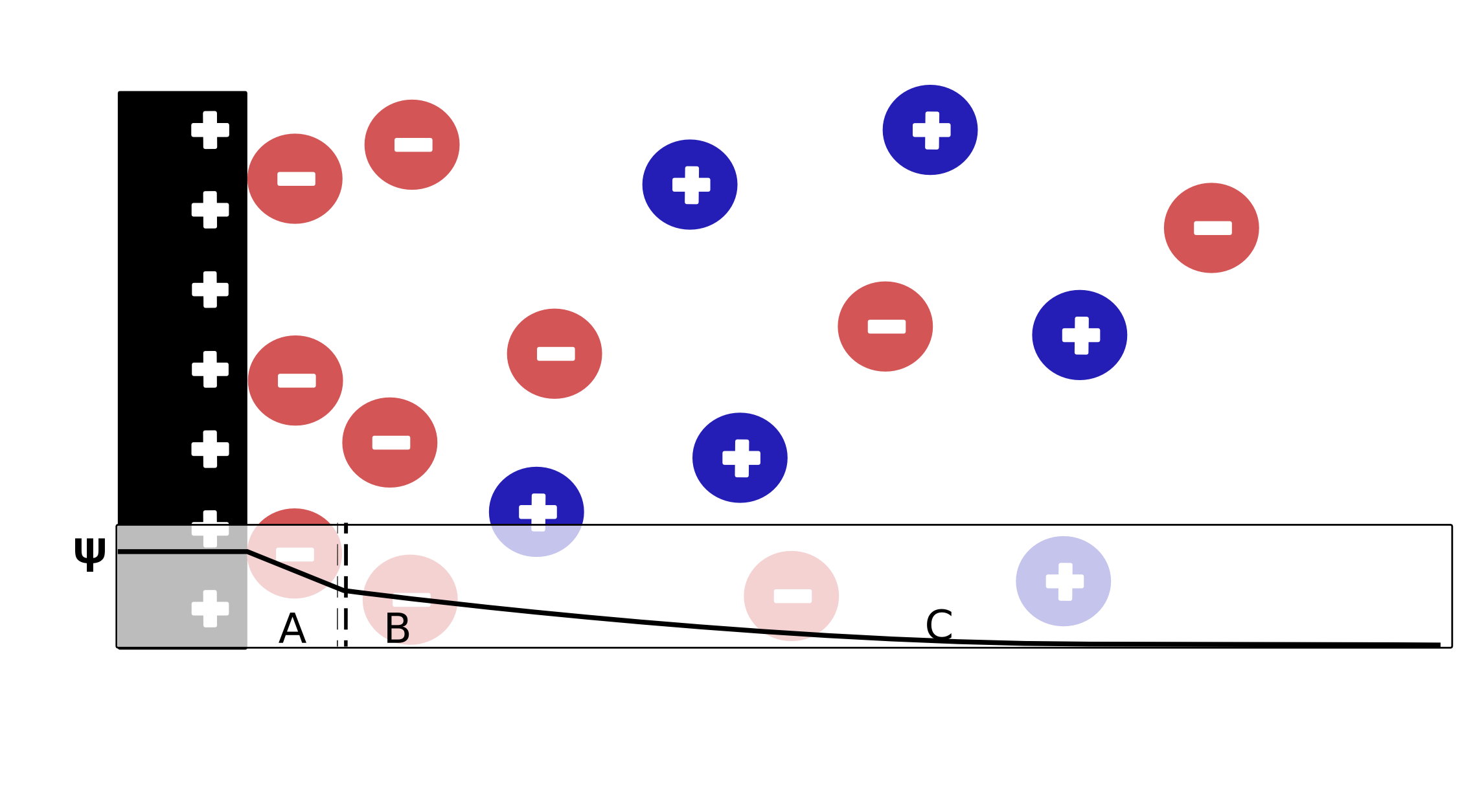
Elektrochemische Doppelschicht
Die elektrochemische Doppelschicht bildet sich als Gleichgewichtsreaktion zwischen Elektrode und Elektrolyt aus. Ist die Elektrode positiv geladen, lagern sich Anionen an die Elektrode an (innere Helmholtzschicht - A). Der Potentialabfall innerhalb dieser Schicht ist linear. Die folgende äußere Helmholtzschicht (B) und die diffuse Sternschicht sind durch einen exponentiellen Potentialabfall gekennzeichnet.
Die Aufladung der elektrochemischen Doppelschicht wird als kapazitiver Strom sichtbar.
Polarisierbar
Eine Elektrode gilt als polarisierbar, wenn bei Anlegen einer Spannung keine Reaktion auf der Elektrodenoberfläche abläuft.
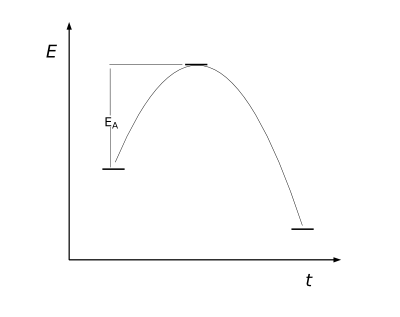
Aktivierungsenergie
Die Aktivierungsenergie wird durch die Arrhenius Gleichung beschrieben. Für den Start der Reaktion muß ein bestimmter Betrag an Energie investiert werden. Die Aktivierungsenergie kann durch Einsatz eines Katalysators verringert werden. Dies ist das Ziel bei der Erforschung neuer Katalysatoren für viele Produktionsverfahren.
Kathode
Die Kathode ist immer negativ geladen, z.B. in der Brennstoffzelle die Seite der Sauerstoffreduktion oder in einer Elektrolysezelle die Seite der Wasserstoffentwicklung.
Anode
Die Anode ist immer positiv geladen, in der Brennstoffzelle die Seite der Wasserstoffoxidation oder in einer Elektrolysezelle die Seite der Sauerstoffentwicklung.
Reversibilität
Eine elektrochemische Reaktion ist reversibel, wenn für die Rückreaktion keine Überspannung benötigt wird. Wird eine geringe Überspannung benötigt, ist die Reaktion quasi reversibel, ist sie hingegen nicht möglich so ist die Reaktion irreversibel.
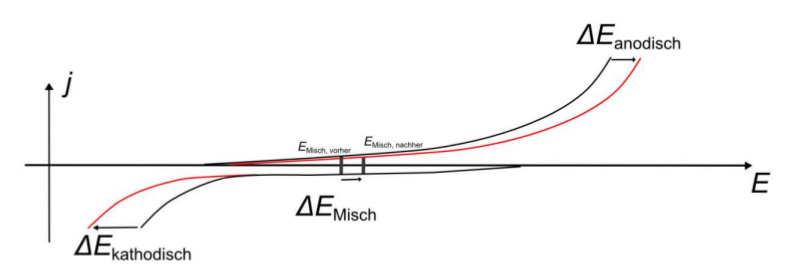
Open Circuit Potential
Das Open Circuit Potential (stromloses Potential) wird im Fall eines Restpotentials gebildet durch die Ausbildung eines Gleichgewichts zwischen anodischem und kathodischem Ausgleichsstromdichten. Die Ausgleichsstromdichte kann kathodisch die Sauerstoffreduktion oder kathodisch die Wasserstoffentwicklung sein.
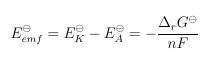
Nernst-Gleichung
.
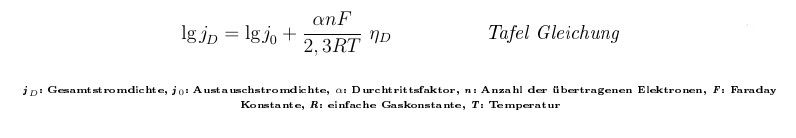
Tafel-Gleichung
.

Cottrell
.
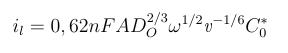
Levich-Gleichung
.
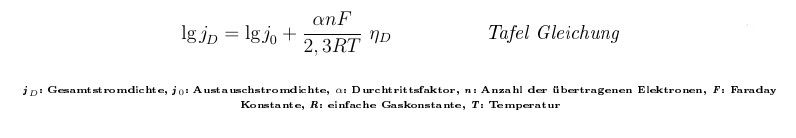
Tafel-Gleichung
.

Koutecky-Levich
.
Keimbildung
Der Begriff Keimbildung impliziert, dass für eine Kristallbildung kleinste Partikel einer neuen Phase gebildet werden müssen, die ein anschließendes Keimwachstum ermöglichen. Keime bilden sich meist auf Oberflächen (Staub, Metall, Glass...). In den meisten Fällen der Keimbildung kann man deshalb davon ausgehen, dass der Keimbildungsort schon bestimmt ist und nicht erst gebildet werden muss. Die Orte der Keimbildung zeichnen sich außerdem durch eine exponierte Oberfläche gegenüber der Umgebung aus.
In der heterogenen Phasenumwandlung treten Keimbildung- und wachstum zuerst an Stufen, Kanten und Defekten auf. Es gibt also bevorzugte Keimbildungsorte. Diese bevorzugten Orte der Keimbildung können in Analogie zur heterogenen Katalyse auch "aktive Zentren" genannt werden. Die molekularen Mechanismen, die sowohl bei der heterogenen, als auch bei der homogenen Keimbildung ablaufen, werden heute intensiv untersucht und lassen spannende Ergebnisse erwarten.
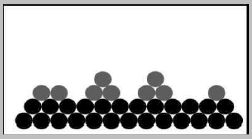
Volmer-Weber
Keime bilden sich direkt auf der Oberfläche des Substrats und wachsen dreidimensional in die Mutterphase. Begünstigt wird dies durch eine niedrige Übereinstimmung der Gitterabstände und Atomgrößen sowie durch eine niedrigere Bindungsenergie.

Frank-van-der-Meerwe
Dies ist ein Sonderfall der Unterpotentialabscheidung. Ursache ist eine geringe Abweichung der kristallographischen Gitterstrukturen von Kation und Substrat. Das Metall wächst epitaxial auf der Oberfläche.

Stranski-Krastanov
Die Schicht wächst epitaxial gefolgt von dreidimensionalem Volmer-Weber Wachstum, bedingt durch eine hohe Abweichung der kristallographischen Gitterstruktur.